Exercices Conversions de l'énergie chimique
Entrainement
- les couples redox mis en jeu sont : ${\text{MnO}_{4}}^{-} / \text{Mn}^{2+}$ et $\text{Fe}^{3+}/ \text{Fe}^{2+}$
- $M(\text{C}) = 12\ \text{g} \cdot \text{mol}^{-1}$ ;
- $M(\text{O}) = 16\ \text{g} \cdot \text{mol}^{-1}$ ;
- $M(\text{H}) = 1\ \text{g} \cdot \text{mol}^{-1}$.
On s’intéresse à la réaction entre l’ion permanganate $({\text{MnO}_{4}}^{-})$ et le cation Fer(II) $(\text{Fe}^{2+})$.
Données :
Écrire la demi-équation d’oxydoréduction, dans l’eau, du couple $\text{Fe}^{3+}/\text{Fe}^{2+}$
Pour réaliser un effort physique, le corps a besoin d’énergie. L’être humain se procure cette énergie en transformant l’énergie chimique produite par la combustion du glucose $(\text{C}_6\text{H}_{12}\text{O}_6)$ dans le corps en énergie mécanique.
Données :
Définir la combustion.
Évaluation
Le chimiste John Daniell mit au point en 1836 une source constante de courant qu’on appelle la pile Daniell. Cette dernière comprend un pôle positif constitué, d’une lame de cuivre plongée dans une solution de sulfate de cuivre, un pôle négatif, constitué d’une lame de zinc plongée dans une solution de sulfate de zinc, et un pont salin. Le fonctionnement de cette pile est basé sur une réaction d’oxydoréduction indirecte.
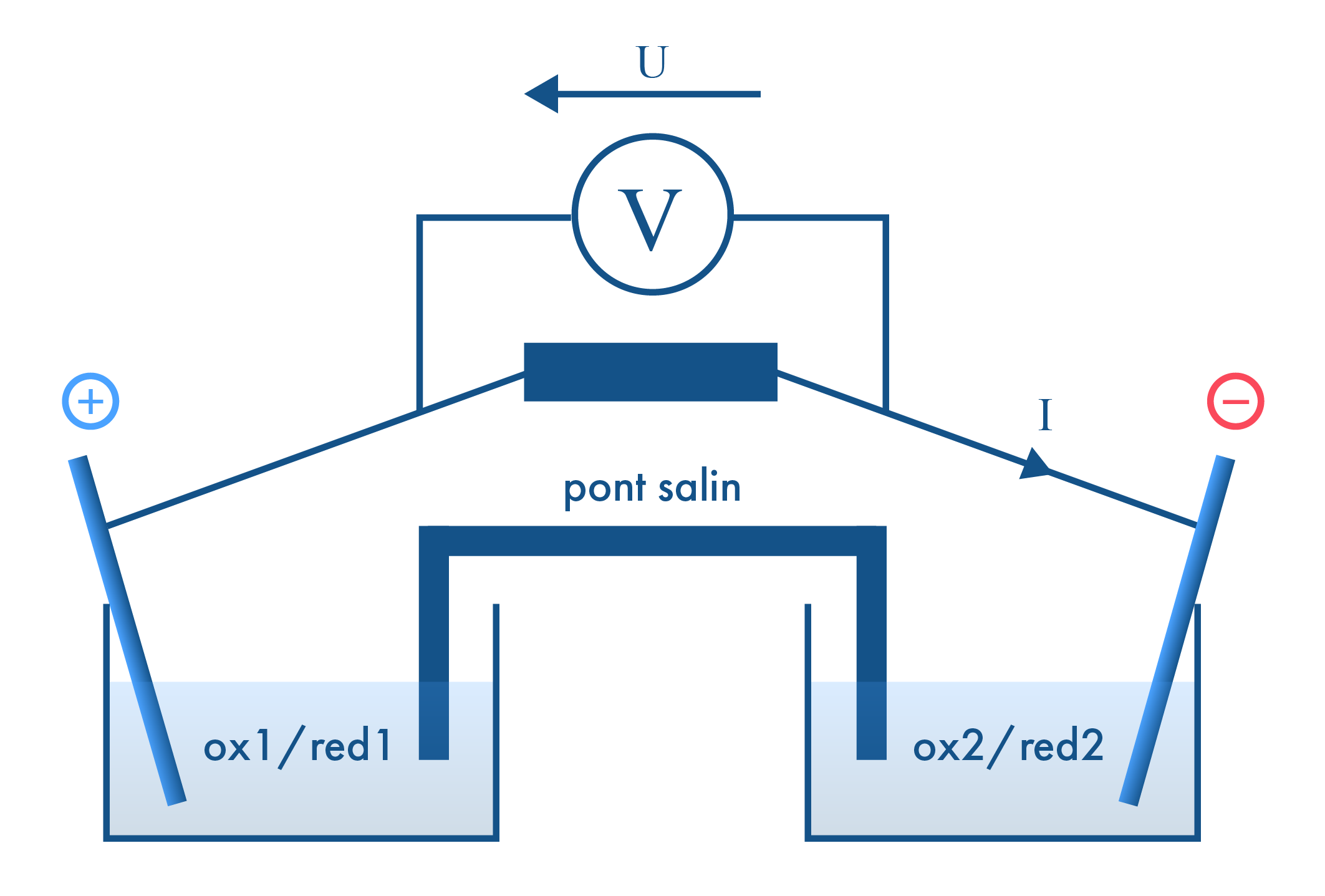
Pourquoi dit-on que la réaction d’oxydoréduction d’une pile électrochimique est indirecte ?
