Exercices Identification des espèces chimiques
Entrainement
- 1/4
Le mercure, autrefois utilisé dans les thermomètres pour indiquer la température, possède des propriétés physico-chimique spécifiques.
Ce métal est liquide dans des conditions normales de température et de pression et voici, en plus certaines de ses caractéristiques :
Température d’ébullition $356,65^\degree\text{C}$ Température de fusion $-38,84^\degree\text{C}$ Masse volumique (à $20\degree \text{C}$) $13,55\ \text {g}\cdot\text{mL}^{-1}$ Que signifie « dans des conditions normales de température » ?
- 1/4
Racha voudrait analyser le médicament que lui a prescrit son docteur pour soigner son rhume. Pour cela, elle réalise une chromatographie sur couche mince (CCM) du médicament ($A$) qu’elle compare à la caféine ($B$), à l’aspirine ($C$), au paracétamol ($D$) et à un autre médicament ($E$).
Après migration de l’éluant, elle obtient la CCM suivante :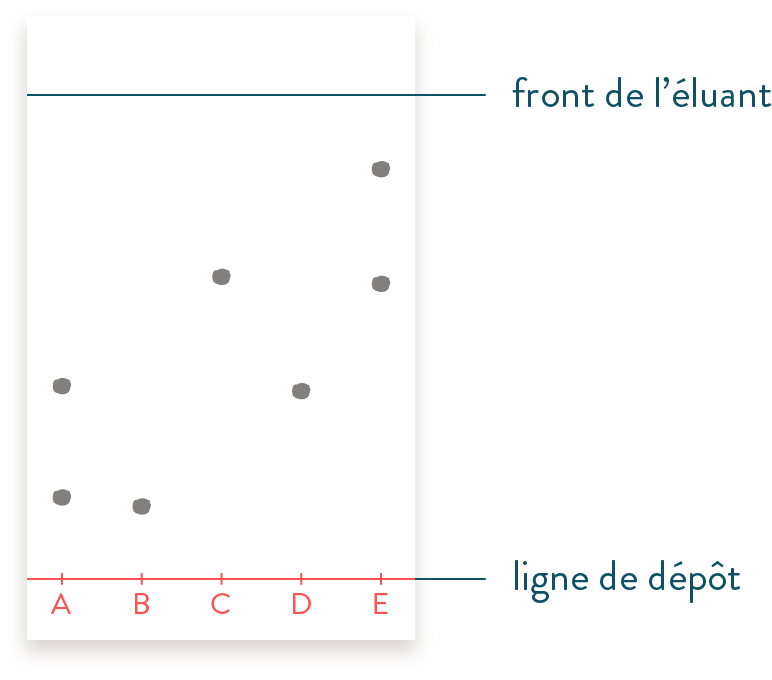
Quel est le rôle de l’éluant ?
Évaluation
- 1/5
On cherche à identifier le meilleur éluant pour effectuer une chromatographie sur couche mince (CCM) d’un mélange de trois espèces chimiques.
Trois solvants sont mis à disposition : l’eau, le diéthyl éther et le dichlorométhane dont les températures d’ébullition et les densités sont indiquées dans le tableau suivant :Solvant Température d’ébullition Densité Eau $100 \degree \text{C}$ $1$ Diéthyl éther $34,6 \degree \text{C}$ $0,713$ Dichlorométhane $40 \degree \text{C}$ $1,33$ Étant donné que le thermomètre affiche $35 \degree \text{C}$, le diéthyl éther est directement éliminé. Deux CCM sont alors effectuées, une avec l’eau comme éluant et une avec le dichlorométhane comme éluant.
Pour quelle raison le diéthyl éther est-il directement éliminé ?
