Exercices La dissolution des solides ioniques et moléculaires
Entrainement
- électronégativité de Pauling de l’oxygène : 3,5
- électronégativité de Pauling de l’hydrogène : 2,1.
L’eau est une molécule simple mais essentielle à toute forme de vie. Elle est constituée d’un atome d’oxygène lié à deux atomes d’hydrogène $(\text{H}_2\text{O})$. Jusqu’à $0\degree \text{C}$, l’eau est solide, de $0$ à $100\degree \text{C}$ l’eau est liquide, et au dessus de $100\degree \text{C}$ l’eau est gazeuse.
Données :
Les liaisons $\text{O}-\text{H}$ sont-elles des liaisons ioniques ou covalentes ?
L’électronégativité est la capacité qu’a un élément à attirer les électrons vers lui dans une liaison qui le lie à un autre atome. L’échelle de Pauling de l’électronégativité varie de 0,7 à 4.
L’électronégativité augmente de bas en haut et de gauche à droite dans le tableau périodique.
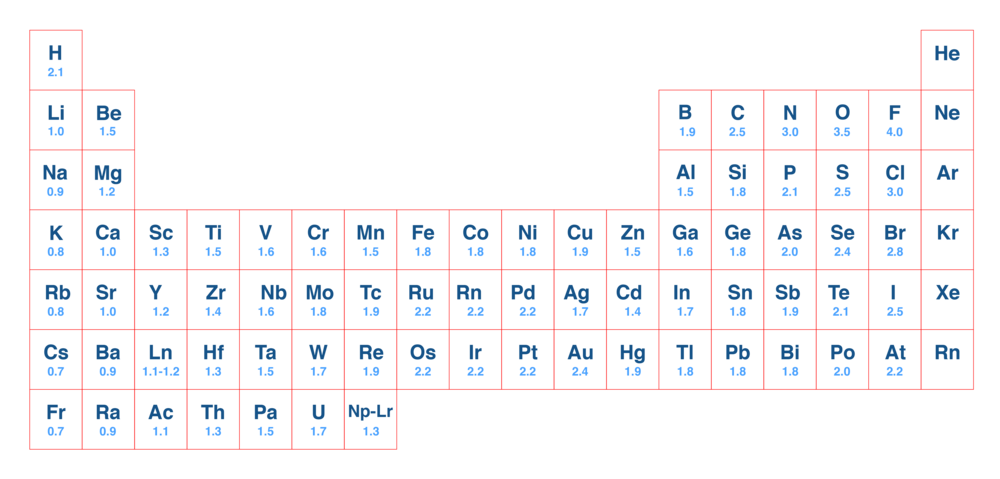
Utilisez l’échelle de l’électronégativité de Pauling pour déterminer si la liaison $\text{K}-\text{Br}$ est une liaison covalente ou ionique.
Évaluation
Lina s’est réveillée un matin avec une forte douleur aux dents. Pour soulager cette rage, elle mélange $5\ \text{g}$ de sel de table $(\text{NaCl})$ dans $250\ \text{mL}$ d’eau tiède. Lorsque Lina ajoute le sel à l’eau, la dissolution prend quelques secondes et nécessite une agitation avec une cuillère. Cette dissolution est en réalité constituée de trois étapes successives.
Données |
Sodium |
Chlore |
Électronégativité de Pauling |
0,9 |
3,0 |
Masse molaire |
23 g.mol-1 |
35,5 g.mol-1 |
Le sel de table est-il un sel ionique ?
