Cours Dilution et dissolution
Introduction :
Dans ce cours, nous allons étudier les protocoles de la dilution et de la dissolution ainsi que les formules associées. Il faut prendre garde à ne pas confondre les deux procédés.
Dans une première partie il sera question de la préparation d’une solution par dissolution d’une espèce solide ou liquide. La seconde partie traitera de la préparation d’une solution par dilution d’une solution existante.
Préparation d’une solution par dissolution d’une espèce solide ou liquide
Rappel sur la concentration massique
La concentration massique d’une espèce en solution se calcule par la formule $C_m=\dfrac{m}{V}$. Elle est donc égale au rapport de la masse de l’espèce en solution par le volume de la solution où elle est dissoute. Mais il existe une autre formule pour la déterminer :
$$C_m=C\times M$$
La concentration massique est aussi égale à la concentration molaire multipliée par la masse molaire. La concentration massique est en gramme par litre, la concentration molaire en mole par litre et la masse molaire en gramme par moles.
Cette relation s’écrit également $C=\dfrac{C_m}{M}$
Il faut savoir manier la concentration massique pour préparer une solution de concentration voulue.
Il existe deux méthodes pour préparer une solution.
Protocole de la dissolution
La préparation d’une solution nécessite l’utilisation de la verrerie de précision, c’est-à-dire des fioles et des pipettes jaugées.
Pour préparer un volume $V$ d’une solution de concentration massique $C_m$ ou de concentration molaire $C$ donnée, il faut d’abord calculer la masse $m$ de soluté nécessaire en utilisant :
- soit la relation $m= C_m \times V$,
- soit la relation $m= C\times M\times V$ ($M$ étant la masse molaire du soluté).
Le protocole de dissolution suit alors plusieurs étapes :
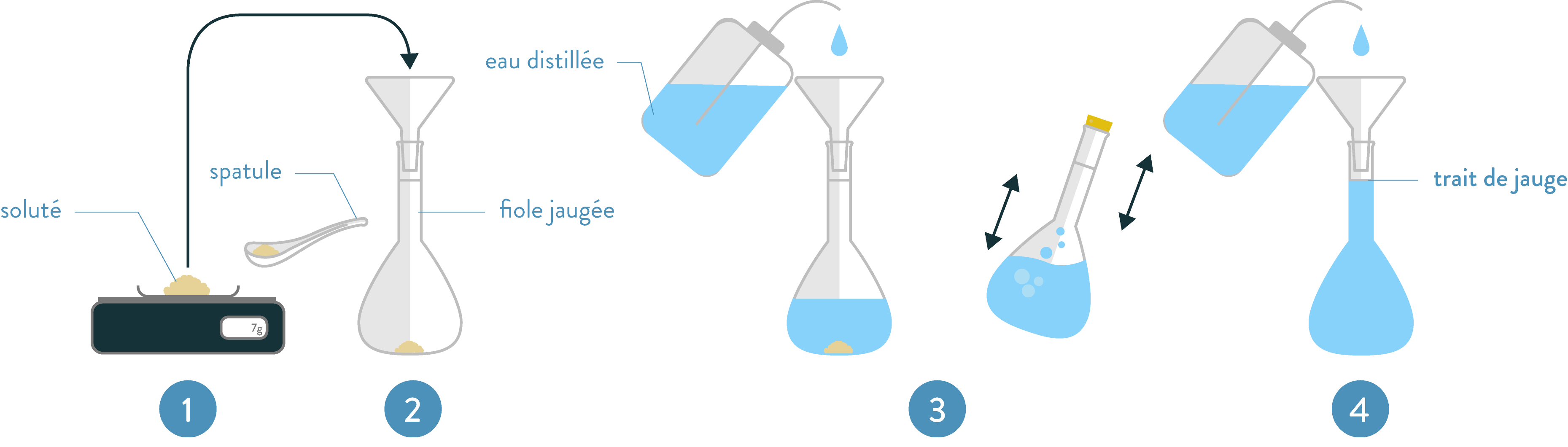 Préparation d’une solution de concentration voulue
Préparation d’une solution de concentration voulue
- On pèse la masse précisément calculée de l’espèce grâce à une balance électronique :
- si l’espèce chimique est solide, on prélève le solide de son flacon à l’aide d’une spatule et on le place dans une coupelle. La coupelle a été préalablement pesée et la balance tarée ;
- si l’espèce chimique est liquide, on prélève le liquide de son flacon à l’aide d’une pipette graduée équipée d’une pro-pipette et on le place dans un bécher. Le bécher a été préalablement pesé et la balance tarée.
- On introduit le solide à l’aide d’un entonnoir, ou on verse le liquide du bécher (si l’espèce chimique est liquide), dans une fiole jaugée de volume égal à celui de la solution que l’on souhaite préparer.
- On remplit la fiole jaugée aux trois quarts avec de l'eau distillée et, après l'avoir bouchée, on agite la fiole pour bien dissoudre le solide.
- On complète avec de l’eau distillée jusqu’au trait de jauge pour obtenir le volume de solution souhaité. On bouche puis on agite la fiole pour bien homogénéiser la solution.
Exemple résolu
On calcule la masse de nitrate d’argent $A_gNO_3$ qu’il faut peser pour préparer une solution de 500 mL de 0,2 mol.L-1.
- $M_{azote} = 14 g.mol^{-1}$
- $M_{argent}= 107,9 g.mol^{-1}$
- $M_{oxygène} = 16 g.mol^{-1}$
- On calcule la quantité de matière $n$ de nitrate d’argent $n_{A_gNO_3}$ contenue dans la solution. Pour cela on utilise la formule $n=C\times V$ après avoir converti le volume $V$ en litre :
$$V=500\ mL=0,5\ L$$
$$n_{A_gNO_3}=A_gNO_3\times V=0,2\times 0,5=0,1 \ mol$$
Pour calculer la masse de nitrate d’argent correspondante $m_{A_gNO_3}$, on utilise la relation $m= n \times M$.
- On calcule la masse molaire du nitrate d’argent $m_{A_gNO_3}$ :
$\qquad\begin{aligned}m_{A_gNO_3}&=M_{argent}+M_{azote}+3\times M_{oxygène}\\&=107,9+14+3\times 16\\&=169,9 g.mol^{-1}\end{aligned}$
- La masse de nitrate d’argent est donc $m_{A_gNO_3}=n_{A_gNO_3}\times M_{A_gNO_3}=0,1\times 169,9=16,99\ g$
Préparation d’une solution par dilution d’une solution existante
Principe de la dilution
On peut préparer une solution par dilution d’une autre solution.
La solution que l'on dilue est appelée la solution initiale ou solution mère ; la solution obtenue est appelée solution finale ou solution fille.
Diluer une solution mère et aqueuse de concentration $C$ et de volume $V$ consiste à lui ajouter de l’eau jusqu’à obtenir le volume $V'$ souhaité d’une solution fille qui sera à une concentration $C'$ plus faible que $C$.
Lors d’une dilution, il y a conservation de la quantité de matière. En effet, si le volume augmente puisqu’on ajoute du solvant, la quantité de matière $n$ de soluté, elle, reste toujours la même.
- Après la dilution, la concentration du soluté dans la solution est donc plus faible.
Si $n$, $C$ et $V$ sont respectivement la quantité de matière, la concentration molaire et le volume de la solution mère ; et si $n'$, $C'$ et $V'$ sont respectivement la quantité de matière, la concentration molaire et le volume de la solution fille, on a la relation : $n = n'$ et donc $C × V = C' × V'$
On appelle facteur de dilution $F$ le rapport du volume de solution fille $V'$ par le volume de solution mère $V$. $$F=\dfrac{V'}{V}$$
Comme la quantité de matière se conserve ($n=n'$), alors $F$ est aussi égal au rapport de la concentration de la solution mère $C$ par la concentration de la solution fille $C'$. $$F=\dfrac{C}{C'}$$
Protocole opératoire de la dilution
 Schéma du protocole de la dilution
Schéma du protocole de la dilution
Une opération de dilution comprend quatre étapes.
- À l’aide d’une pipette jaugée de volume approprié et équipée d’une poire à pipeter ou pro-pipette, on prélève le volume de solution mère nécessaire pour obtenir une solution fille à la concentration souhaitée. La solution mère a été au préalable placée dans un bécher de volume adapté.
- On introduit la solution prélevée dans une fiole jaugée dont le volume sera égal au volume souhaité pour la solution fille.
- On remplit la fiole jaugée aux deux tiers avec de l'eau distillée et on l’agite latéralement.
- On complète avec de l’eau distillée jusqu’au trait de jauge, puis on bouche et on agite vigoureusement la fiole pour bien homogénéiser la solution fille ainsi obtenue.

Exemple résolu
Prenons par exemple une solution de permanganate de potassium de concentration molaire $C=4×10^{-3}\ mol.L^{-1}$.
On calcule le volume de solution à prélever pour obtenir une solution de 300 mL et de concentration molaire $C'=10^{-3}\ mol.L^{-1}$.
Dans cet exemple, on note $V$ et $C$ les volume et concentration de la solution mère, $V'$ et $C'$ les volumes et concentration de la solution fille.
- La quantité de matière de permanganate de potassium que l’on prélève dans la solution mère est :
$$n= C \times V= 4×10^{-3}\times V$$ $V$ étant le volume cherché.
- La quantité de matière de permanganate de potassium dans la solution fille est :
$$n'= C' \times V'= 10^{-3}\times 0,3 = 3×10^{-4} mol$$
- On utilise la relation de conservation de la matière. $n=n'$ donc $C\times V=C'\times V'$ et :
$$V=\dfrac{C' V'}{C}=\dfrac{3×10^{-4}}{4×10^{-3}}=0,075 L=75\ mL$$
- Pour obtenir $300$mL de solution fille, on a donc prélevé $750$mL de solution mère auxquels on a rajouté $300-75$ soit $225$mL de solvant.
Récapitulatif des formules impliquant la quantité de matière
Les formules qui mettent en jeu la quantité de matière sont donc très nombreuses. Cependant, il est possible de les récapituler très simplement, ce qui aide à les retenir. Voici un bilan de tout ce qu’il faut savoir sur la mole, la quantité de matière et les concentrations.
- Le rapport entre la masse et la quantité de matière donne la masse molaire $M=\dfrac{m}{n}$. On a ainsi $m=n\times M$ et dans l’autre sens $n=\dfrac{m}{M}$
- Le volume d’une solution et la masse de l’espèce chimique qui y est dissoute sont liés par la masse volumique $\rho$ qui s’exprime en gramme par litre $\rho =\dfrac{m}{V}$. Quand on cherche à trouver la masse on utilise $m=\rho \times V$, et lorsqu’on veut déterminer le volume, on utilise $V=\dfrac{m}{\rho}$
- Masse molaire et masse volumique sont utilisées conjointement dans les formules $V=\dfrac{n\times M}{\rho}$ et $n=\dfrac{\rho\times V}{M}$


